ÁCIDOS Y BASES DÉBILES Y FUERTES clasificación , grado de disociación y pH Ejemplos YouTube

¿Esto sucede? Sí, lo hace. ¿Por qué? Porque HC 2 H 3 O 2 es un ácido débil. Cualquier posibilidad de que se forme un ácido débil, lo hará (lo mismo con una base débil). Como algunos iones C 2 H 3 O 2 − se hidrolizan con H 2 O para producir el ácido molecular débil, se producen iones OH −. Los iones OH − hacen que las.
pH Ácidos fuertes y débiles Par ácidobase conjugada YouTube
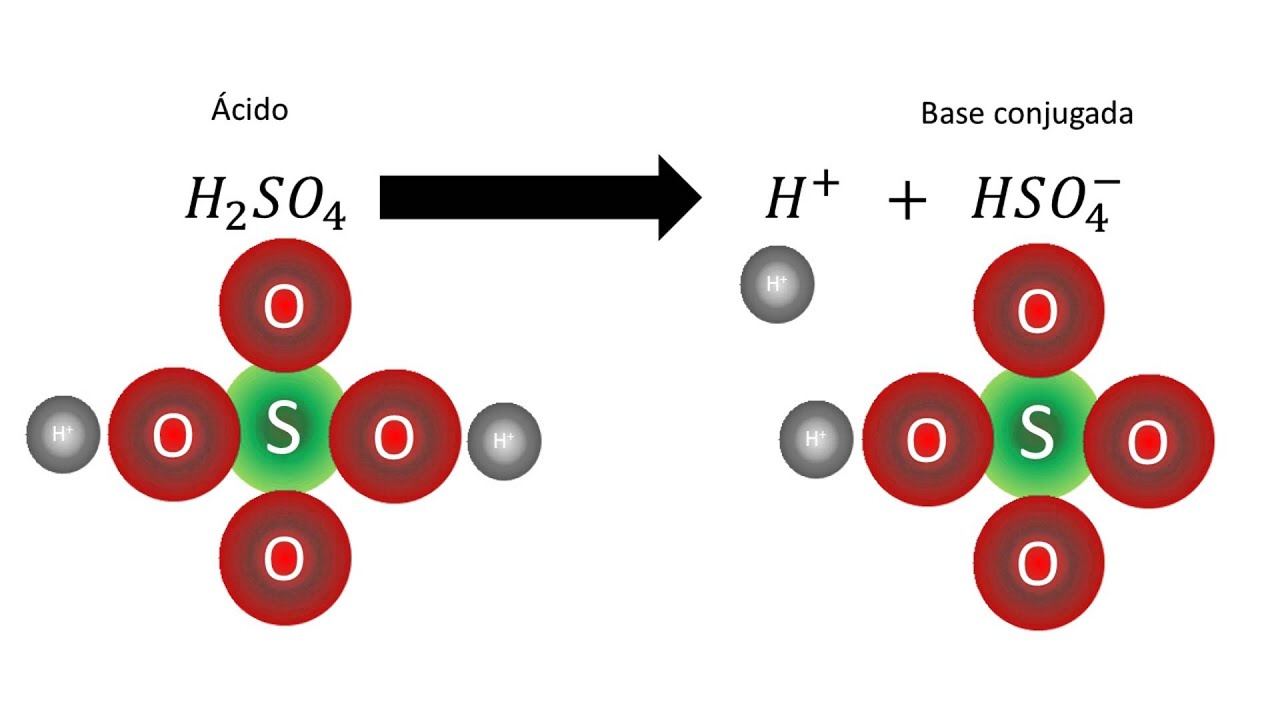
Un ácido débil es un ácido que no produce muchos iones de hidrógeno (H +) cuando está en una solución acuosa. Por el contrario, un ácido fuerte es un ácido que produce muchos iones de hidrógeno. Propiedades. Los ácidos débiles tienen un sabor agrio, se sienten pegajosos y, a menudo, queman las fosas nasales cuando se huelen.
Cálculo de pH y de disociación en Acido debil YouTube

Ácido débil. Es un ácido que cuando está en solución acuosa se ioniza parcialmente, es decir, no se transforma completamente en los iones que componen su molécula. Por tanto, la concentración de iones en solución de este tipo de ácido es menor que en uno fuerte. Por ejemplo: el ácido cítrico, el ácido carbónico (H 2 CO 3) Base débil.
Valoración de un ácido débil YouTube

En otras palabras, un ácido débil es cualquier ácido que no es un ácido fuerte. La fuerza de un ácido débil depende de cuánto se disocia: cuanto más se disocia, más fuerte es el ácido. Para cuantificar la fuerza relativa de los ácidos débiles, debemos analizar la constante de disociación ácida K a , que representa la constante.
CLASIFICACIÓN DE LOS ACIDOS Y BASES POR SU CONDUCTIVIDAD FUERTES Y DÉBILES Curso para la UNAM

Tenemos que tener en cuenta que podemos sustituir la concentración del ácido, ya que es un ácido débil y casi ninguna de las moléculas se disocia: el equilibrio está muy a la izquierda. Por tanto, podemos decir que la concentración de ácido etanoico en el equilibrio sigue siendo aproximadamente la concentración inicial al despreciar el.
pKa y pH Constante de acidez para ácidos débiles YouTube

La concentración de H + deja de ser neutra cuando se añade un ácido o una base a una solución acuosa (basada en agua). Para nuestros propósitos, un ácido es una sustancia que aumenta la concentración de iones hidrógeno (H + ) en una solución, usualmente al donar uno de sus átomos de hidrógeno por disociación.Una base, en cambio, aumenta el pH al aportar iones hidroxilo (OH.
Cálculo de pH Ácidos y Bases Débiles Parte 1 YouTube

Un ácido débil es aquel que en disolución acuosa tiene poca capacidad de disociarse en hidrógeno (H+) y en su correspondiente base conjugada. A diferencia de los ácidos fuertes, cuya disociación es completa (100%) y prácticamente irreversible, los ácidos débiles apenas se disocian y de un modo reversible.
20 Ejemplos de Ácidos
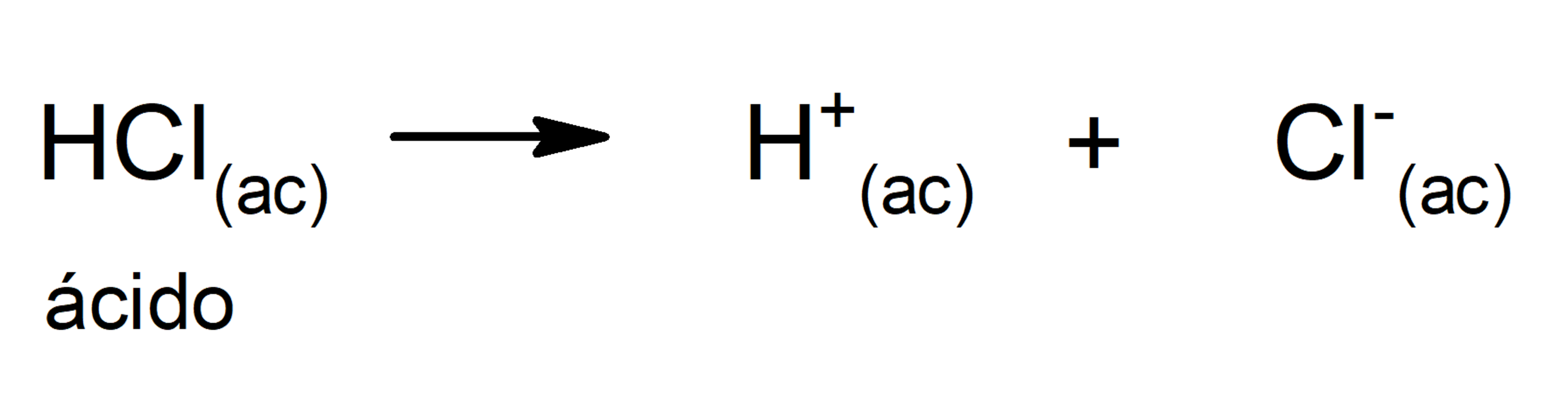
Y cuando el amoníaco acepta un protón, se convierte en NH4 más el ion amonio, por lo tanto, el ion amonio es el ácido conjugado de NH3. Digamos que mezclamos moles iguales de nuestro ácido débil HF con nuestra base débil NH3 y nuestro objetivo es averiguar si la solución resultante es un ácido, una base o es neutra.
Titulación de un ácido débil con una base fuerte YouTube

K 1 = 1,71x10 -2. Un ácido débil es aquel ácido que no está totalmente disociado en una disolución acuosa. 1 Aporta iones al medio, pero también es capaz de aceptarlos. Si representáramos el ácido con la fórmula general HA, en una disolución acuosa una cantidad significativa de HA permanece sin disociar, mientras que el resto del.
PPT Acidos , Bases y Electrolitos PowerPoint Presentation, free download ID4710627

La titulación de un ácido débil con una base fuerte (o de una base débil con un ácido fuerte) es algo más complicada de lo que se acaba de discutir, pero sigue los mismos principios generales. Consideremos la titulación de 25.0 mL de ácido acético 0.100 M (un ácido débil) con hidróxido de sodio 0.100 M y comparemos la curva de.
Cálculo de pH Ácido Débil YouTube

Un ácido débil es aquel ácido que no está totalmente disociado en una disolución acuosa. Aporta iones H + al medio, pero también es capaz de aceptarlos. Si representáramos el ácido con la fórmula general HA, en una disolución acuosa una cantidad significativa de HA permanece sin disociar, mientras que el resto del ácido se disociará.
5 ejemplos de ácidos fuertes y uno debil Brainly.lat

Te puede interesar ver más ejemplos de ácidos y bases.. Ácidos y bases débiles. Un ácido o una base es débil cuando en solución acuosa se ioniza parcialmente, esto es, en la disolución se encuentra iones y moléculas no ionizadas. ¿Cómo se ioniza un ácido y una base débil? Un ácido débil, como el ácido acético CH 3 COOH, se ioniza de la siguiente forma:
PPT REACCIONES DE ACIDOS Y BASES PowerPoint Presentation, free download ID4425007
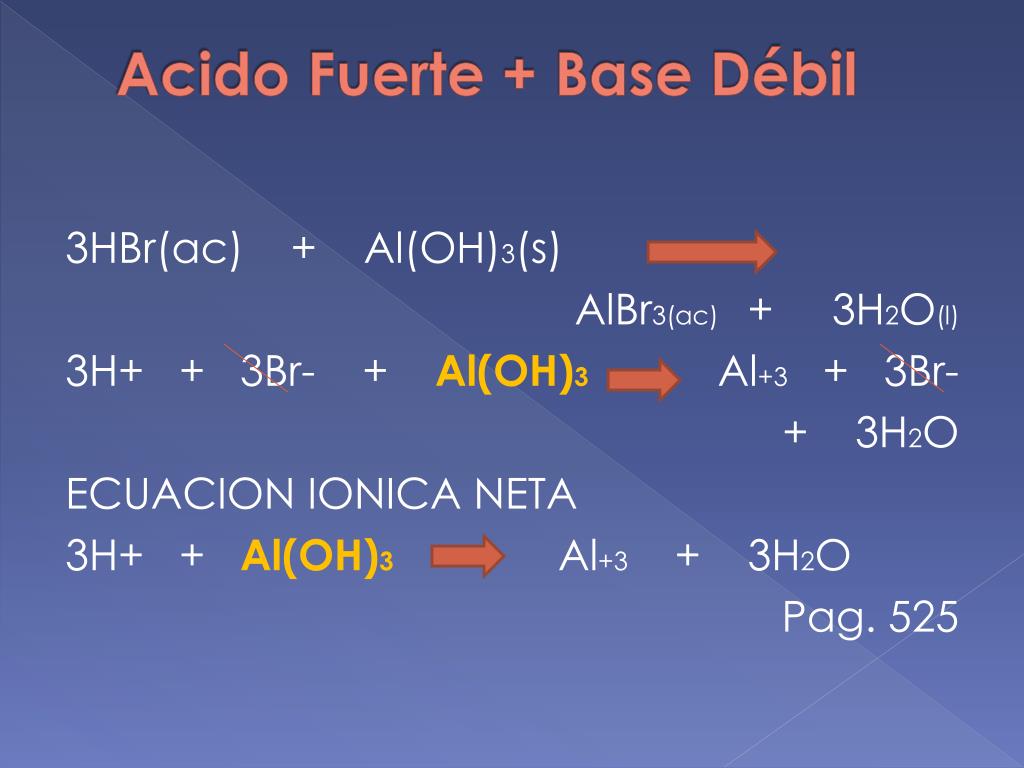
Aunque el ácido sulfúrico es fuerte, la carga negativa sobre el ión sulfato de hidrógeno mantiene el protón más apretado, por lo que el ion es un ácido considerablemente más débil. Los ácidos como H 2 SO 4 , H 2 S, H 2 SO 3 y H 2 CO 3 se denominan dipróticos porque pueden donar dos protones.
cálculo de pH ácido fuerte y débil comparación final YouTube

Titulación de bases débiles y ácidos fuertes. En una titulación de base débil - ácido fuerte, el analito es la base débil y el valorante es el ácido fuerte. Una base débil se disociará sólo parcialmente mientras que un ácido fuerte se disociará completamente. Un ejemplo de base débil es el amoníaco, NH 3.
Cálculo del pH de un ácido débil YouTube
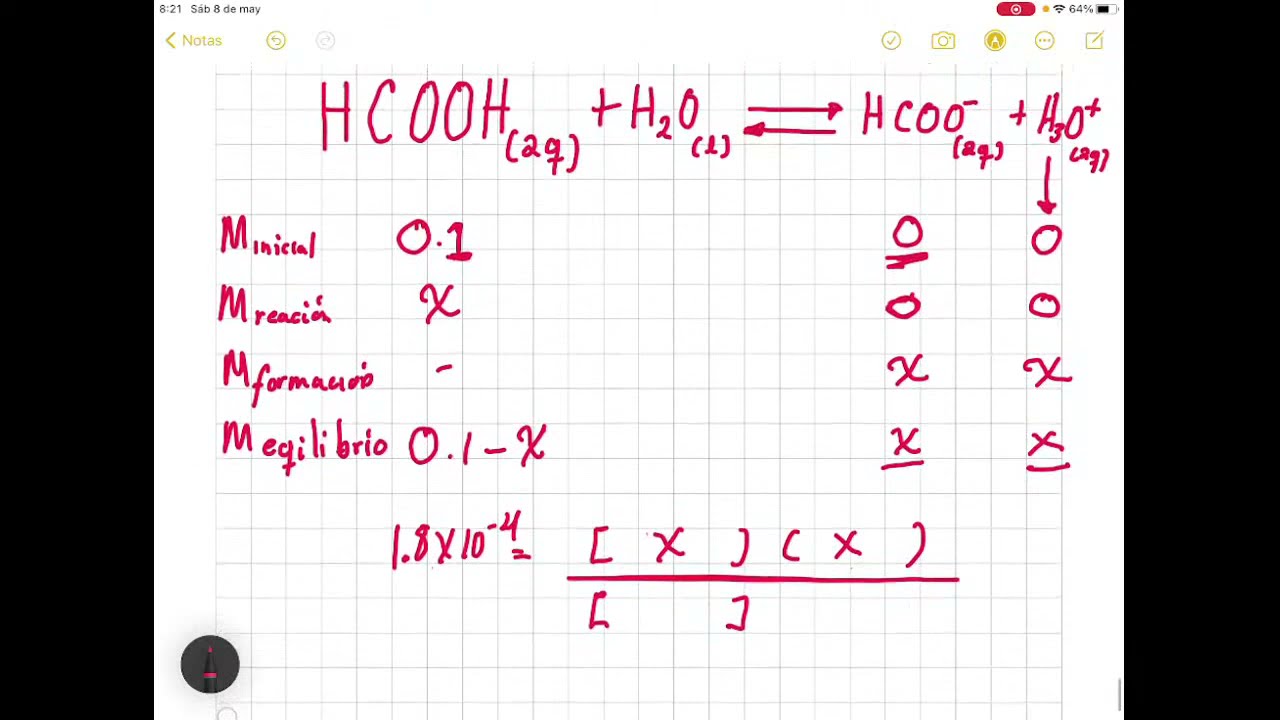
Un ácido débil es un ácido que se ioniza solo ligeramente en una solución acuosa. El ácido acético (que se encuentra en el vinagre) es un ácido débil muy común.. Debido a que el ácido es débil, se puede escribir una expresión de equilibrio. Una constante de ionización ácida \(\left( K_\text{a}.
Acido debil base fuerte

Durante la titulación o valoración de un ácido débil con una base fuerte, se forma de hecho una solución amortiguadora o tampón. Así que veamos más detalles de la región de amortiguación en la curva de valoración. El área donde se tiene un sistema amortiguador o región de amortiguación se produce alrededor del punto medio de.
.

